El propósito del estudio fue el de comprobar la calidad de dos medicamentos genéricos que contienen paracetamol y que se comercializan en México y Estados Unidos. El ensayo de disolución constituye una técnica relativamente rápida y económica para la evaluación de materias primas y formas farmacéuticas.
En ciertos casos la aprobación de los medicamentos por la Secretaria de Salud (SSA) o la Administración de Alimentos y Drogas (FDA por sus siglas en inglés) de acuerdo al ensayo de disolución in vitro es una condición suficiente para aceptar su comercialización.1-3
Existe una preocupación por ambas autoridades, la SSA en México, así como la FDA de los Estados Unidos de Norte América por la venta indiscriminada de medicamentos en la frontera México-Estados Unidos, y es que la FDA ha externado que muchos de los medicamentos que en la frontera mexicana se comercializan, no son de buena calidad o son falsos. Muchos de estos medicamentos son producidos en países como Taiwán, China, México y la India.4
En diversos comunicados la FDA recomienda a los ciudadanos norteamericanos que al visitar México se abstengan de comprar medicamentos ya que estarían en riesgo inclusive de perder la vida por consumir medicamentos comprados en México.5
Primera fase, encuesta de investigación
Se parte del diseño de una encuesta de 10 preguntas hecha en campo que el objetivo de ésta es obtener un listado de los medicamentos que con más frecuencia se comercializan en las farmacias que se encuentran establecidas muy cerca de la franja fronteriza de la ciudad de Tijuana y el poblado de Algodones Baja California con Estados Unidos.
Una vez que se obtuvo el listado de medicamentos se seleccionó uno de ellos que en base al listado de medicamentos susceptibles de incorporarse al catálogo de genéricos intercambiables emitido por la Secretaría de Salubridad vigente tuviera indicado como prueba de intercambiabilidad la prueba de perfiles de disolución o prueba “B”.
Metodología de la Prueba de Perfiles de Disolución
El método analítico para la evaluación de los perfiles de disolución que se utilizó es el establecido por la Farmacopea de los Estado Unidos Mexicanos (F.E.U.M.) en las monografías de pruebas de intercambiabilidad.
Procedimiento para la validación del método analítico para las pruebas de perfiles de disolución.
Se hizo de acuerdo a la Norma NOM-177-SSA1 vigente7.
Resultados
Tabla No. 1 Lista de los Medicamentos más vendidos en las ciudades encuestadas.
| Denominación genérica | Denominación genérica | Denominación genérica |
| Ibuprofeno | Penicilina | Alendronato sódico |
| Amoxicilina | Algestona y estradiol | Esomeprazol |
| Ac. Acetil Salicilico | Betametasona/clotrimazol/gentamicina | Amlodipino |
| Hidroxocobalamina, vitaminas B1 y B6 | Tretinoína | Clopidogrel |
| Diclofenaco sódico y vitaminas B1, B6 y B12 | Oxitetraciclina | Salmeterol y fluticasona |
| Naproxen sódico | Tramadol | Paracetamol |
| Vardenafil | Sildenafil | Simvastatina |
| Atorvastatina | Celecoxib | |
| Omeprazol | Loratadina |
Resultados de las pruebas de perfiles de disolución
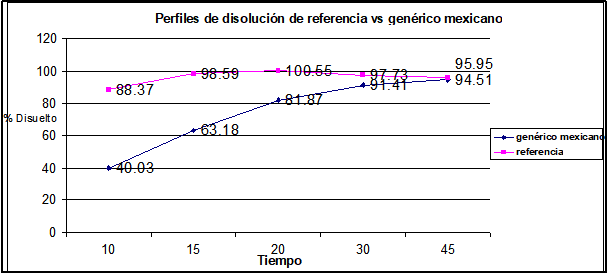
Gráfica No. 1. Perfiles de disolución promedio del producto de referencia vs el producto genérico mexicano
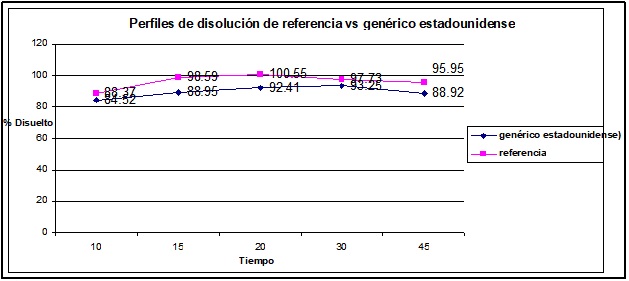
Gráfica No. 2. Perfiles de disolución promedio del producto de referencia vs el producto genérico estadounidense.
Gráfica No. 3. Perfiles de disolución promedio del producto de referencia vs los productos de prueba estadounidense y mexicano.
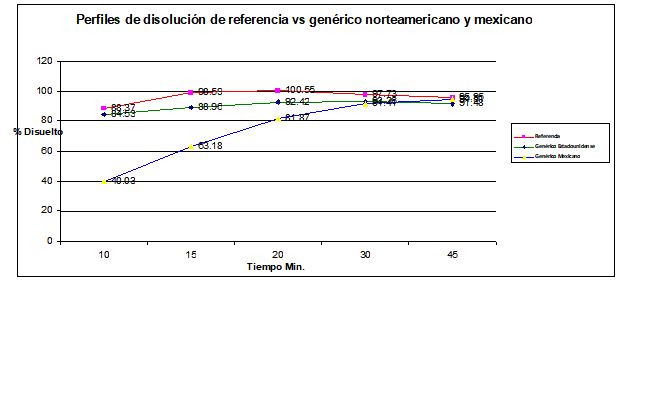
Las gráficas de los porcentajes disueltos contra el tiempo del genérico estadounidense y el de referencia esquematizan el comportamiento de la liberación del fármaco por cada una de las formulaciones, confirmando que existe similitud entre ambos perfiles de disolución de estas dos formulaciones.
Para el caso del genérico mexicano vs el de referencia podemos observar que existe una diferencia superior al 20% en el porcentaje disuelto al primer tiempo y más de 10% en dos de los tiempos subsecuentes, por lo que no es posible aplicar la estadística del factor de similitud o algún método estadístico alterno puesto que es evidente la diferencia entre ambos perfiles de disolución y se muestra claramente la diferencia que existe en la liberación del principio activo entre cada una de estas formulaciones.
Si tomamos en cuenta que el paracetamol se absorbe rápida y totalmente en el tracto gastrointestinal y alcanza su concentración plasmática máxima a las 2 horas es necesario que a los primeros minutos en que se ha ingerido el medicamento se tenga completamente disuelto y liberado el principio activo, para que este se pueda absorber en la primera parte del tracto gastrointestinal.
El tiempo promedio del vaciamiento gástrico es de entre 15 y 20 minutos, por lo tanto, es necesario que justo antes de este tiempo se tenga de ser posible el 100% del fármaco liberado como sucede en el caso del medicamento de referencia, mientras que en el caso del genérico mexicano para este tiempo solo se tiene poco más del 60% del fármaco liberado, por lo que esto evitaría que un 40% del fármaco no se alcanzara a absorber correctamente.
En el caso del medicamento de referencia podemos observar que, para los 15 minutos, se tiene liberado el 98% del fármaco por lo que se puede absorber completamente en el estómago y primer tercio del intestino delgado y alcanzar los niveles sanguíneos en poco tiempo como es necesario que suceda.
El genérico estadounidense a los 15 minutos tiene el 88% del fármaco liberado y el 92% a los 20 minutos, con lo que se tiene el fármaco disponible para su absorción de forma correcta.
Conclusiones
Es evidente que hay medicamentos genéricos que se comercializan en estos lugares que no cumplen con las pruebas de intercambiabilidad, por lo que no se sabe en realidad si son seguros y eficaces; y el problema de salud que esto puede provocar en la población puede ser serio, y no solo para los consumidores en México si no para un sector importante de la población en Estados Unidos que cruzan a México en busca de medicamentos más baratos.
La venta de medicamentos a norteamericanos por parte de farmacias mexicanas establecidas en la frontera representa utilidades de unos 1,000 millones de dólares y solo en el 2002 se surtieron unos 2 millones de recetas médicas a extranjeros, y es que hay medicamentos que llegan a ser hasta un 85% más baratos en México que en Estados Unidos8.
Esta fuente de ingresos por la venta de medicamentos a extranjeros representa una utilidad importante para nuestro país por lo que es necesario que se asegure que los medicamentos que son comercializados en esta frontera sean de buena calidad, asegurando con ello la entrada de estas divisas a nuestro país, que representan el sustento de miles de familias que dependen del comercio de los medicamentos en la frontera.
Es de suma importancia mantener un monitoreo permanente en estas zonas que eviten la comercialización de medicamentos piratas o que no cumplan con las pruebas de intercambiabilidad que aseguren la seguridad y eficacia de estos.
Referencias Bibliográficas
- Recasens Briansó J, Suñé Negre J. M. 0. Ensayo de disolución “in vitro” de medicamentos: Condiciones y factores que influyen en la velocidad de disolución. Far 1990; 308:319 – 330.
- Skoug J.W. Estrategia para el desarrollo y validación de pruebas de disolución para formas sólidas orales. Pharmaceutical technology 1996; (12): 8 –14.
- Rescigno A. 1992 “Bioequivalence”. Pharmaceutical Research, 9(7): 925-8.
- Alerta EU sobre venta de Viagra pirata en la frontera con México, Cronica de hoy, (notimex, Washington) 25/05/2005.
- Imported Drugs Raise Safety Concerns, S. Food and Drug Administration, FDA Consumer magazine, September-October 2002.
- Farmacopea de los Estados Unidos Mexicanos 9na. Edición 2005 Pag. 2136.
- Norma Oficial Mexicana 177 (NOM-177-SSA1-1998) de la Secretaría de Salubridad Mexicana.
- Diario la Opinión “La importación de medicinas baratas falsificadas a EU significó ventas de unos 1,000 millones de dólares, afirman”, 02 de marzo de 2004.
Autores: Miguel Ángel Chávez G, José Manuel Cornejo B., Idolina Radilla C. y Héctor Miguel Gamón R.
Autor Responsable: Miguel Ángel Chávez González
Tel. (667)790-7683
Email: miguel_angelchavez@hotmail.com

Artículos Relacionados: