La neoplasia maligna intraocular, médicamente conocida como retinoblastoma y popularmente llamada cáncer de ojo, es uno de los cánceres más agresivos en niños menores de 5 años, y de los más difíciles de diagnosticar.
“Es uno de los principales cánceres infantiles que afecta a la población mundial. Se dice que el retinoblastoma ocupa un 5% de incidencia a nivel mundial”, afirmó la investigadora del Instituto de Física de la Universidad Autónoma de San Luis Potosí (UASLP), Vanesa Olivares Illana quien participó recientemente en el Seminario de Biología de Sistemas del Centro de Ciencias de la Complejidad (C3) de la UNAM.
La académica, quien fundó el Laboratorio de Interacciones Biomoleculares y Cáncer en la UASLP, está dando pasos importantes para entender cuál es el sofisticado mecanismo que propicia este cáncer con el objetivo de desarrollar un método de diagnóstico temprano y algún tratamiento en el futuro.
Según el Registro de Cáncer en Niños y Adolescentes (RCNA 2019) de la Secretaría de Salud de México reporta que el retinoblastoma representa el 5% del total de casos de personas con cáncer, sin contar la leucemia. Pero la investigadora comenta que estos datos no son fidedignos: “En México las estadísticas no existen. No hay estadísticas confiables que sean llevadas bien por las instituciones…y de lo que nos hemos dado cuenta es que la incidencia en México es mayor que en el resto del mundo. Por ejemplo, en México hay un estudio donde se vio que este 5%, en algunos estados, puede aumentar hasta el 26%, como es el caso de Chiapas.”
En el 2011, la revista médica del Instituto Mexicano del Seguro Social publicó un estudio en el que se encontró que Chiapas es el estado del país que tiene una mayor incidencia en cánceres infantiles, entre los que se cuenta el retinoblastoma, y que afectan mayormente a niños menores de 5 años. El caso de retinoblastomas en Chiapas es alarmante pues desde ese entonces ya contaba con 21.4% de incidencia, porcentaje mayor al registrado en el 2019 por el RCNA.
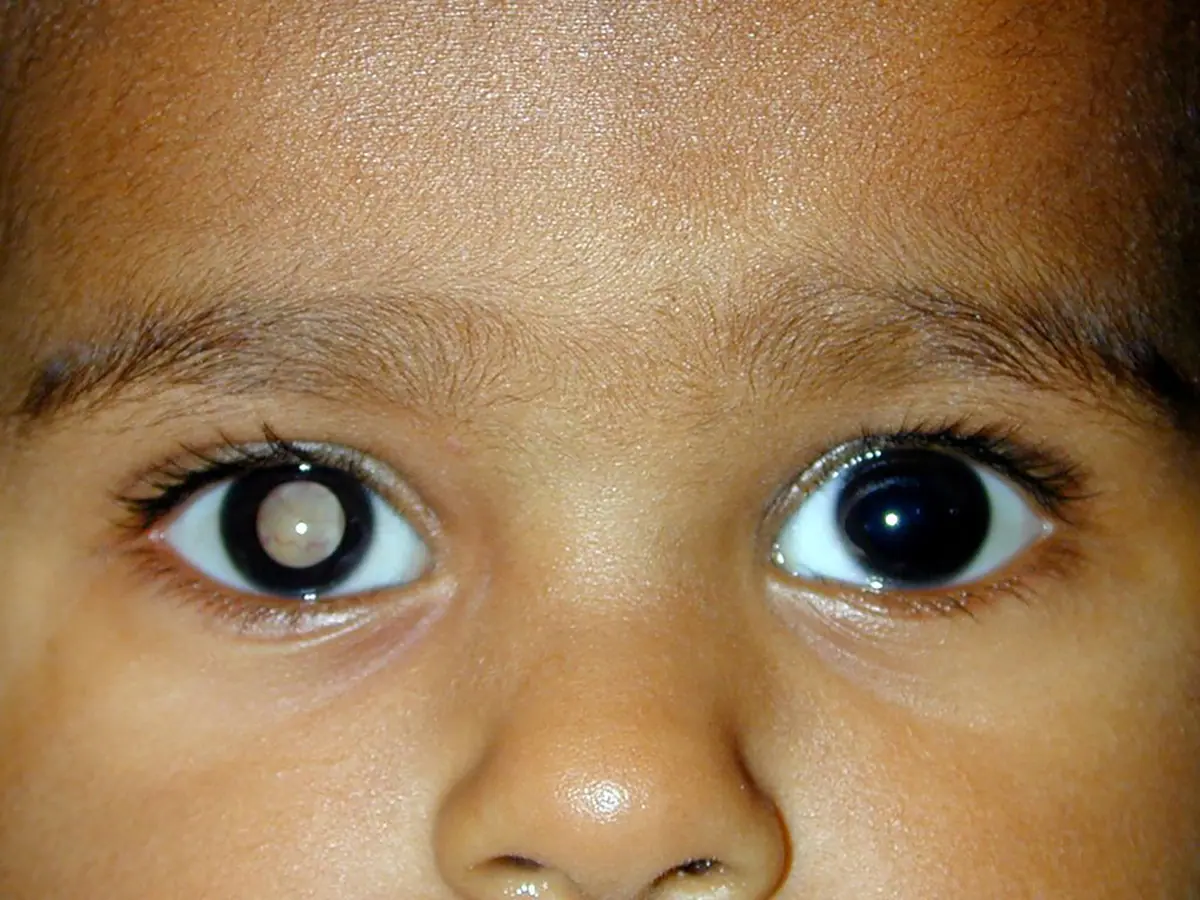
“Este tipo de cáncer…en realidad es muy poco conocido, es inclusive desconocido entre el sector médico de primera instancia”, explica Olivares Illana. La falta de conocimiento dificulta su diagnóstico oportuno y, en consecuencia, propicia que el tumor crezca, que el paciente pierda la vista y, en casos extremos, muera.
Y hay evidencia de eso. En su tesis de maestría, publicada en 2007, el hoy investigador del Instituto Nacional de Pediatría, Héctor Díliz Nava, aplicó un cuestionario con 16 reactivos para evaluar el conocimiento sobre retinoblastoma a 719 estudiantes de medicina de último año de 12 diferentes universidades de distintos estados del país y los resultados fueron desalentadores: el 96.7% de los participantes no alcanzaron una calificación de suficiencia, mientras que el 60.3% ignora los signos más frecuentes de la enfermedad –leucocoria (reflejo blanco en el fondo del ojo) y estrabismo. Su conclusión fue que la mayor parte de los estudiantes no cuentan con el conocimiento mínimo necesario para diagnosticar oportunamente la enfermedad.
De acuerdo con Olivares Illana, “generalmente en México es la familia la que nota que algo está pasando en el ojo del niño y va con el doctor y ya el doctor hace su evaluación clínica y observa ciertos signos que pueden estar diciendo que el niño puede padecer retino”. Pero cuando la intervención médica sucede es demasiado tarde para el niño, por lo que el único tratamiento posible es la enucleación (extirpación de globo ocular).
Extraer el globo ocular es el tratamiento más común para el retinoblastoma, pues es la manera más eficaz de evitar la propagación del tumor y, en consecuencia, la muerte del infante. “En la actualidad hay muchos tratamientos, ha habido una gran investigación en tratamientos, en contra del retinoblastoma como la crioterapia, la termoterapia, la radioterapia, la quimioterapia localizada, sin embargo todos estos esfuerzos no se ven recompensados porque, en nuestro país y en muchas partes del mundo, el tratamiento por elección, el primer tratamiento es la enucleación y esto es debido a que (suele ser) demasiado tarde para salvar la vista y para salvar el glóbulo ocular se prefiere enuclear porque el riesgo de metástasis es muy alto”, explica la investigadora.
El hecho de que el tratamiento de retinoblastoma no haya cambiado en dos siglos ha impulsado el trabajo de la académica y su equipo con el objetivo de encontrar un método de diagnóstico temprano para el retinoblastoma.
“Al ser una enfermedad que se puede detectar desde el nacimiento, lo que queremos hacer es, antes de que se le vean los primeros signos, saber si el niño ya está desarrollando retinoblastoma, porque entonces se pueden usar esos tratamientos tan maravillosos que se han estado desarrollando y que pueden salvar no sólo el ojo sino la visión y darle al niño una vida normal, con un tratamiento, pero una vida normal”, dice Olivares Illana. La clave para entender su estudio está en la proteína MDM2.
Una proteína clave
La proteína MDM2 es una proteína esencial en el estudio del retinoblastoma y otros tipos de cáncer porque tiene muchas conexiones con muchas otras proteínas. Gracias a su flexibilidad, la MDM2 “interacciona con más de cien proteínas en diferentes momentos celulares”, dice Olivares Illana.
Dos de esas interacciones son aún más importantes cuando hablamos de cáncer; la MDM2 interactúa con dos proteínas que actúan como supresores tumorales: p53 y Rb. La p53 es “el protector del genoma”, dice la investigadora, pues si encuentra un error en el DNA al momento de la división celular toma la decisión de detener el proceso (arresto de ciclo) para así dar tiempo a que se repare el daño o, si es muy grave el desperfecto, propicia el suicidio de la célula (proceso conocido como apoptosis). Por su parte, Rb (retinoblastoma) es la proteína encargada de controlar el ciclo celular mediante el procedimiento conocido como arresto celular, es decir, detiene el proceso de división celular en caso de no hallar las condiciones necesarias para la división celular.
Esto quiere decir que tanto p53 como Rb sirven para proteger a las células, reparar daños si los detectan e impedir que las ya mutadas (las cancerosas) se repliquen. Así que, si hay algún problema entre estos dos supresores y la proteína MDM2 que los regula, el cáncer podría desarrollarse.
Entonces, se sabe que la proteína MDM2 se encarga de regular p53 y Rb, pero lo interesante es que hay ocasiones en que la MDM2 impulsa la producción, y otras en las que detona la degradación de estos supresores tumorales. Así que Olivares Illana decidió concentrarse en esta proteína para responder una pregunta intrigante: ¿cómo es posible que una proteína sea capaz de, en ciertos momentos, actuar como un oncogen (causante de tumores) y, en otros, como un potenciador de un supresor tumoral (atenuante de tumores)
Así que, desde hace 10 años, la investigadora desarrolló un proyecto para dilucidar cómo es que la MDM2 interactúa con estos supresores tumorales.
La MDM2 en el laboratorio
Olivares Illana creó en su laboratorio una especie de réplica de MDM2 que pudiera imitar a la proteína en estado silvestre (sin interacción) y otra que mimetizara la fosforilación (MDM2 P ). Esto le permitió observar que la MDM2 fosforilada cambia su estructura “de tal manera que ahora exponen regiones que antes estaban ocultas, u ocultan otras que estaban expuestas y eso le da la posibilidad de hacer una cosa o la otra”. Esta dualidad es justamente lo que le permite ser oncogen o ser potenciador p53.
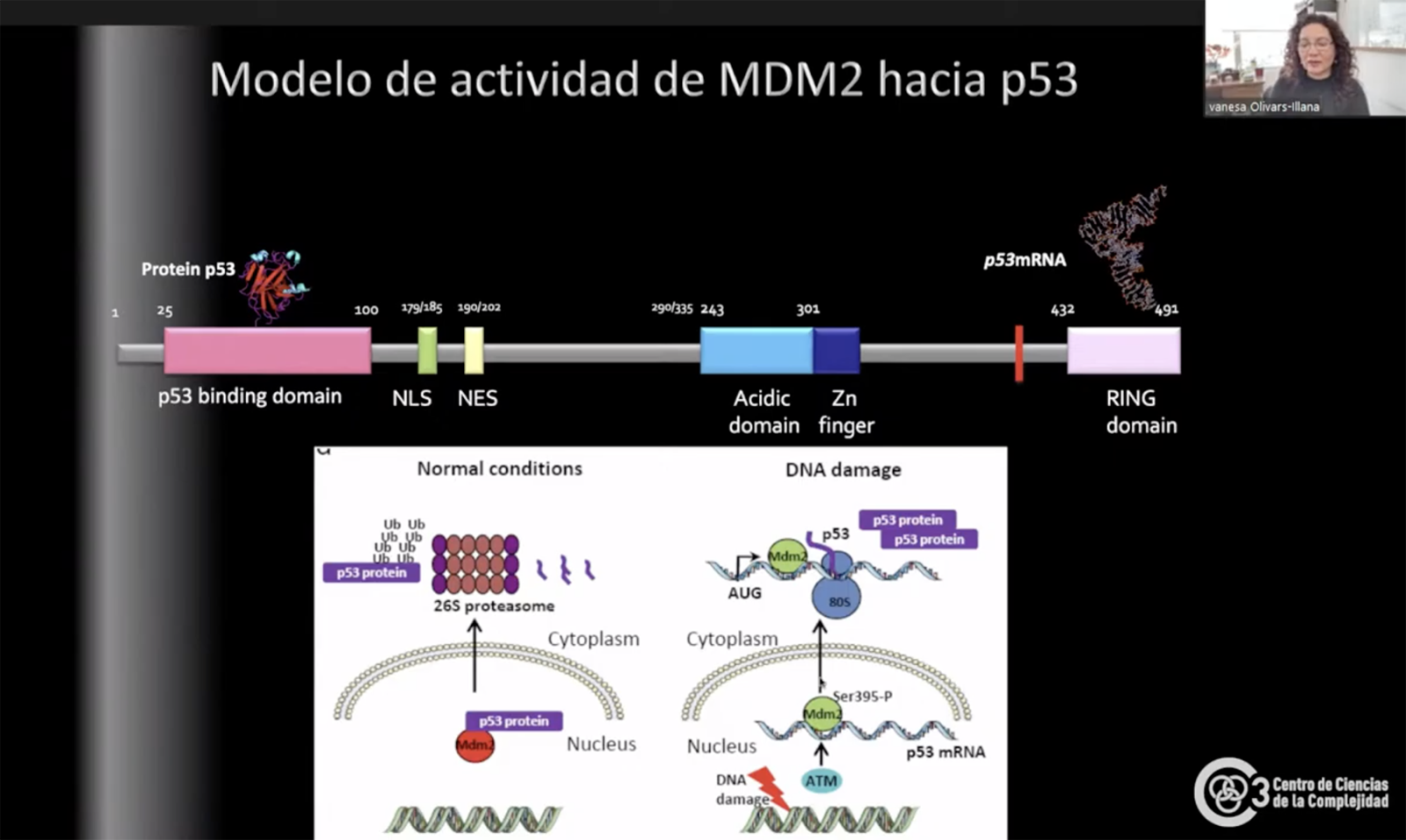
Interacción MDM2 y p53 en estado normal (izquierda) y con daño a DNA (derecha)
La investigadora también logró comprender el mecanismo que activa a MDM2 en relación con p53: básicamente la MDM2 (la parte silvestre y la mutante –MDM2 P ) reconoce a p53 y la degrada, pero, si está presente el RNA mensajero de p53 (p53 mRNa-MDM2), no sucede eso.
Entendiendo este mecanismo, Olivares Illana tiene la ambición de crear un fármaco que “tenga la capacidad de imitar la interacción con el mensajero” para evitar la degradación de p53 y poder combatir el cáncer. Este tipo de fármaco sólo sería efectivo en el caso de exceso de presencia de MDM2 (por ejemplo, cánceres como retinoblastoma o melanoma) que degrada a p53 pues ayudaría a bloquear los MDM2.
¿Y cómo se conecta con el retinoblastoma?
La enfermedad retinoblastoma es un tipo de cáncer que “se produce porque hay mutación en el gen RB1”, el cual fue descrito por primera vez en 1809 por el oftalmólogo escocés James Wardrop. Esta mutación en el gen afecta a la proteína retinoblastoma ‘Rb’, que es considerada –como ya vimos– un supresor tumoral, pues anula la capacidad de la célula de saber cuándo parar de reproducirse (proliferación continua) y a cada división aumentan las mutaciones dando como resultado cáncer y metástasis.
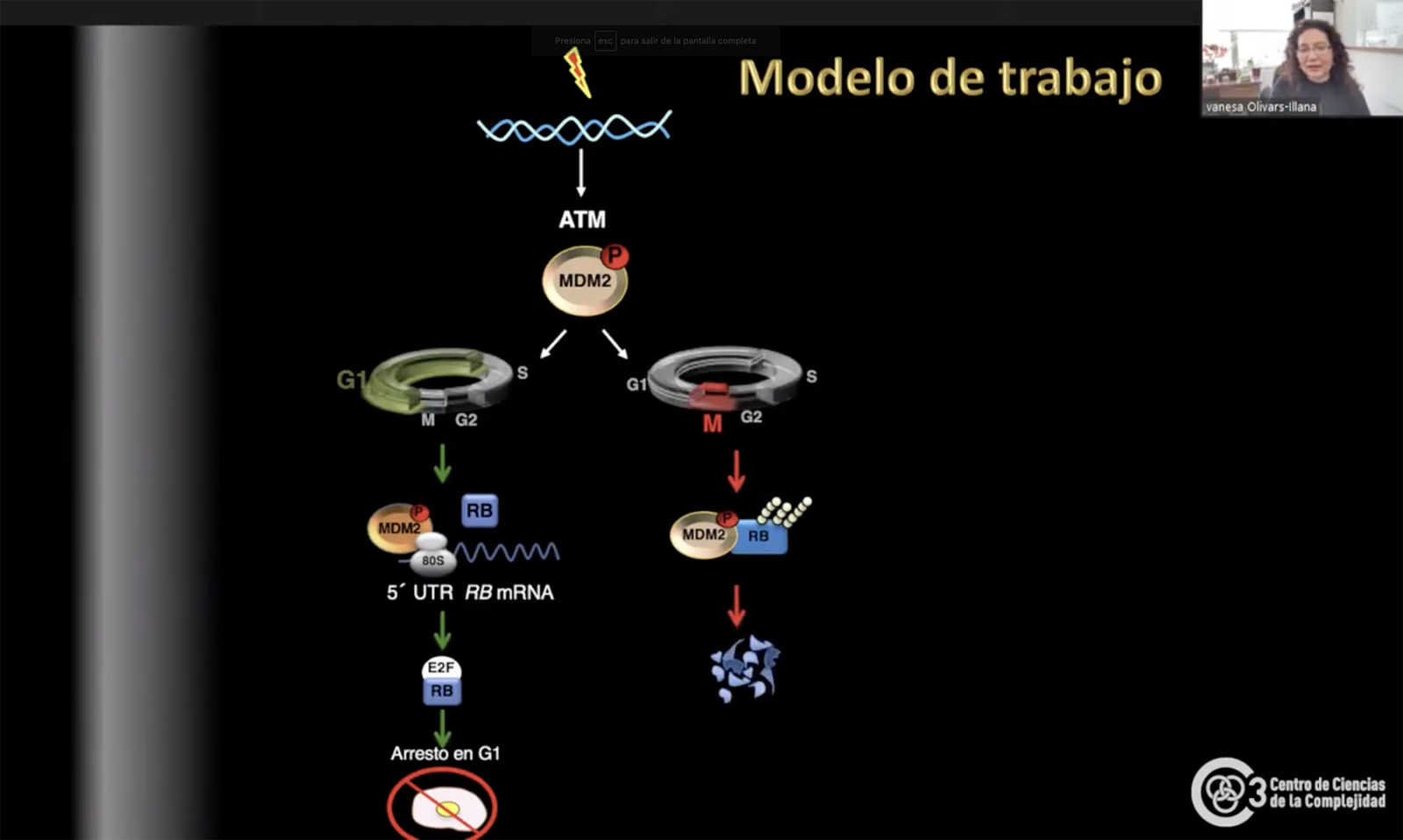
Interacción MDM2 y p53 en estado normal (izquierda) y con daño a DNA (derecha)
La ‘Rb’ se encarga de controlar el ciclo celular, el cual está conformado por cuatro etapas (G1, S, G2 y M) que fungen como puntos de control que evalúan el estado interno de la célula y el ambiente que le rodea para decidir si proceder o no con la división. Este proceso no se lleva a cabo todo el tiempo, sino que requiere de un estímulo que lo detone, ejemplo una herida.
Es en la primera etapa de la división que Rb lleva a cabo su actividad. En condiciones de estrés genotóxico (daño al DNA), Olivares Illana observó que MDM2 aumenta los niveles de Rb para que éste interaccione con E2F1 (proteína que sintetiza los genes para la duplicación del DNA), y detenga la división celular evitando mutaciones dañinas para el organismo.
Rb se presenta como un caso fascinante pues su actividad como supresor tumoral depende de la fase en la que se encuentre la división celular. Si el daño es hallado durante la primera fase, el proceso se detiene, pero si este se encuentra en la fase G2 la división celular continúa.
Por el momento, Olivares Illana ha logrado describir el mecanismo que activa a MDM2 en relación con Rb en condiciones de daño al DNA pero aún queda camino por recorrer para poder entender la dualidad de MDM2 en las etapas de la división celular para que en un futuro exista un tratamiento contra el retinoblastoma que sea menos invasivo que la enucleación y que se pueda llevar a cabo en etapas tempranas de la enfermedad.


Artículos Relacionados:
Estrés: Por qué ocurre y cómo manejarlo
El síndrome de Stevens-Johnson puede ser mortal
Los pacientes de cáncer de hígado contarán con una nueva opción terapéutica
¿Por qué no puedes dormir? Causas del insomnio y tratamiento
Experta ofrece sugerencias para prevenir y controlar los dolores de cabeza, desde migrañas hasta cef...