Supresión del apetito
Investigadores liderados por Ioanna Mosialou (doi: 10.1038/nature21697) examinaron ratones incapaces de producir LCN2 en los osteoblastos. Estos animales comieron más comida y ganaron más peso que los roedores de tipo silvestre. Además, su capacidad de metabolizar la glucosa estaba alterada. Los ratones que carecen de LCN2 en todas sus células exhiben los mismos rasgos, lo que confirma la importancia de la secreción de LCN desde el hueso. Sobre la base de estas observaciones, los investigadores plantearon la siguiente hipótesis: LCN2 actúa como una hormona reductora del apetito. LCN2 se identificó por primera vez hace más de 20 años y los ratones que no la sintetizan fueron generados hace 13 años para estudiar su inmunidad, sin embargo la obesidad leve en estos ratones mutantes aparentemente pasaron desapercibidos.
Los autores encontraron que la secreción de LCN2 del hueso aumentó varias veces tras una comida, lo que indica que su liberación hacia la sangre es sensible a las señales nutricionales. Para demostrar que LCN2 es realmente una hormona (una molécula de señalización que se transporta entre los órganos por el sistema circulatorio), Mosialou y sus colegas dieron a los animales diariamente inyecciones de LCN2 purificado para lograr concentraciones sanguíneas similares a los alcanzados después de una comida. Este tratamiento suprimió el apetito de ratones de tipo silvestre, que perdieron peso en comparación con animales control (no tratados). Las inyecciones diarias de LCN2 en ratones obesos, redujeron su ganancia de peso y mejoraron la capacidad de la insulina para estimular la absorción de glucosa en las células.
Debido a que el comportamiento alimentario es controlado por el cerebro, los autores midieron la cantidad de LCN2 en varias regiones del cerebro, y evidenciaron que era más abundante en el tronco encefálico e hipotálamo – regiones que controlan la conducta alimentaria. Cuando LCN2 se inyectó directamente en el cerebro, suprimió la alimentación con tanta eficacia como lo hizo en la sangre. Los investigadores concluyeron que LCN2 producida en los huesos, circula en la sangre, cruza la barrera hematoencefálica y se enriquece selectivamente en regiones del cerebro asociadas con la supresión del apetito (anorexia).
El descubrimiento de una nueva hormona, especialmente una derivada del hueso, es intrigante, pero Mosialou y sus colegas se dispusieron a completar la historia identificando la proteína receptora responsable de la anorexia inducida por LCN2. Las pistas acerca de dónde encontrar tal receptor pueden ser encontradas a partir de la observación del enriquecimiento de LCN2 en el hipotálamo, combinado con el hecho de que una de las mejores vías establecidas promotoras de anorexia es la vía de señalización que implica la participación de la hormona estimulante de α-melanina (α-MSH, por sus siglas en inglés). En esta vía, α-MSH es producida por las neuronas en el hipotálamo y suprime el apetito por interacción con el receptor de melanocortina 4 (MC4R), un miembro de una familia de proteínas llamadas receptores acoplados a proteína G.
Por lo tanto, los investigadores exploraron la posibilidad de que LCN2 de alguna manera pueda imitar la señalización de α-MSH. De hecho, encontraron que, bajo condiciones in vitro, LCN2 estimula la producción de AMP cíclico, por parte de células que expresan cualquiera de los tres receptores de melanocortinas (MC1R, MC3R o MC4R), pero no en células que carecen de estos receptores. Este hallazgo apoya la idea de que LCN2 se une a los receptores de melanocortina. De estos receptores, MC4R se expresa en el tronco encefálico y en el hipotálamo, y se ha relacionado con el comportamiento alimentario. La afinidad de LCN2 por MC4R fue similar a la de α-MSH, y LCN2 podría competir con α-MSH por el sitio de unión a MC4R, a pesar de que las dos moléculas no tienen similitudes obvias.
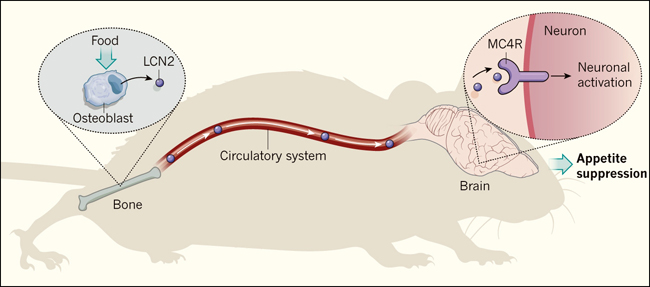
Figura 1: Un eje hueso-cerebro modula el hambre.
Mosialou y sus colegas reportaron que después de que los ratones se alimentan, los nutrientes absorbidos son detectados por las células que forman los huesos, llamadas osteoblastos, que responden liberando la glucoproteína lipocalina 2 (LCN2). LCN2 entra en el torrente sanguíneo y circula por el organismo, pasando al hipotálamo. Aquí, la glucoproteína se une a receptores proteicos de melanocortina 4 (MC4R) en neuronas. La activación neuronal por la unión a MC4R induce una vía de señalización que conduce a la pérdida de apetito.
Una prueba adicional de que LCN2 promueve la anorexia mediante la activación de MC4R (figura 1) provino de la demostración de que la hormona se une a zonas del hipotálamo donde hay presencia de MC4R, sin embargo no lo hace en ratones que no expresan este receptor. Además, demostraron que LCN2 no tenía efectos biológicos sobre la ingesta de alimentos o metabolismo de la glucosa en ratones que carecen de MC4R. Las personas con mutaciones en MC4R son a menudo obesas, y algunas de ellas poseen niveles elevados de LCN2 en su sangre en comparación con individuos sin mutaciones en MC4R. Este resultado sugiere que la señalización desde el cerebro hacia los huesos controla la producción de LCN2 en un intento para establecer la homeostasis.
Aunque los autores concentraron sus esfuerzos en la unión de LCN2 a MC4R en el hipotálamo, estos receptores también son abundantes en el nervio vago, que se proyecta desde la mayoría de los órganos internos hasta el cerebro posterior, donde puede activar un circuito neural que promueve la anorexia. Estos MC4R vagales son más accesibles a las hormonas circulantes que los receptores hipotalámicos, porque no se encuentran detrás de la barrera hematoencefálica. Como tal, pueden estar involucrados en la supresión del apetito inducida por LCN2 después de una comida.
Actualmente, es bien sabido que la sepsis, una condición causada por bacterias, o inducidas experimentalmente por la inyección de lipopolisacárido bacteriano a roedores, produce una profunda anorexia. LCN2 es fuertemente inducido en muchas células por esta condición, por lo tanto, también puede contribuir a la anorexia causada por sepsis. En suma, es bueno recordar que aún se pueden encontrar funciones inesperadas de las hormonas ya conocidas mediante observaciones astutas y experimentos críticos.
Fuente bibliográfica
Physiology: Bone-derived hormone suppresses appetite
Richard D. Palmiter
Howard Hughes Medical Institute, University of Washington, Seattle.
doi:10.1038/nature21501


Artículos Relacionados:
Seis hormonas que potencian nuestro bienestar
Testosterona- qué es, para qué sirve y efectos
Muy frecuente, el prolapso de la vejiga en mujeres
Descubierta una hormona capaz de fortalecer los huesos
Andropausia, la menopausia masculina